Kurze Wege, gemeinsame Nutzung von Infrastruktur und ein Team vernetzter Köpfe, die über den eigenen Tellerrand hinwegschauen ─ das ist das Erfolgsrezept des Projekthauses NanoBioMater der Universität Stuttgart, in dem gemeinsam von Biologen, Chemikern, Materialwissenschaftlern und Ingenieuren intelligente biokompatible Funktionsmaterialien für die Medizintechnik, Diagnostik und Umweltanalytik entwickelt werden. Die Carl-Zeiss-Stiftung ermöglicht das Projekt mit einer Fördersumme von 750.000 Euro.
Prof. Wolfram Ressel dankte der Carl-Zeiss-Stiftung für die Förderungszusage und sagte: „Das Projekthaus NanoBioMater bündelt bisher bestehende erfolgreiche Einzelinitiativen und bilaterale Kooperationen im Bereich der Biomaterialien rund um die Universität Stuttgart. Die Fördersumme von 750.000 Euro bietet nicht nur die Chance, die internationale Sichtbarkeit der Stuttgarter materialwissenschaftlichen Aktivitäten zu erhöhen, sondern das Projekthaus NanoBioMater soll auch durch zielführende Vorarbeiten die Basis für eine erfolgreiche Einwerbung eines künftigen Transregio-Sonderforschungsbereiches bei der DFG bieten.“
Unter der Federführung von Prof. Sabine Laschat (Institut für Organische Chemie) und Prof. Thomas Hirth (Institut für Grenzflächenverfahrenstechnik und Plasmatechnologie) soll im Projekthaus NanoBioMater ein Kernteam aus zwei Hochschullehrern, Prof. Christina Wege (Biologisches Institut) und Prof. Günter Tovar (Institut für Grenzflächenverfahrenstechnik und Plasmatechnologie und Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik), sowie drei interdisziplinär arbeitenden Postdoktoranden die Entwicklung von neuen Hydrogelen als Funktionsmaterialien vorantreiben.
Natürliche Biomaterialien wurden im Laufe der Evolution hervorgebracht und optimiert. Sie sind skalenübergreifend von der molekularen Ebene im Nanomaßstab über Meso-, Mikro- bis hin zu Makro-Größenordnungen in Zusammensetzung und Struktur auf ihre natürlichen Funktionen abgestimmt. Um erkrankte Organe zu unterstützen oder sogar zu ersetzen, konzentriert sich die Medizintechnik heute vorwiegend auf harte synthetische Materialien wie Metalle, Keramiken oder Polymere sowie auf Hybridmaterialien aus diesen Komponenten. Der menschliche Körper ist jedoch aus Geweben aufgebaut, welche aus zellulären und extrazellulären, komplex aufgebauten Biomaterialien bestehen. Wasser macht 70 % der menschlichen Körpermasse aus; biologische Substanzen treten deshalb überwiegend in Form hydrogelartiger Strukturen auf, die per se weiche Materie darstellen. Hydrogel-basierte Materialien, die biokompatibel und in nahezu beliebigen Strukturen und Formen herstellbar wären, eröffnen daher den Weg zu dringend erforderlichen ergänzenden Komponenten bis hin zum ganzen Organ. Aufgrund der demographischen Entwicklung, der abnehmenden Verfügbarkeit sowie den Risiken von Spenderorganen, und um die Zahl an Tierversuchen zu reduzieren, besteht ein stetig steigender Bedarf an solchen "maßgeschneiderten "künstlichen Geweben" auf Hydrogel-Basis. Diese sind zudem eine ideale Matrix für biochemische Erkennungs- und Katalysereaktionen, welche eine Diagnostik mit bioaffinen Peptiden und Antikörpern sowie enzymatische Aktivitäten ermöglichen. So stellen sie auch wichtige Komponenten miniaturisierter Biosensoren und "Lab-on-a-Chip"-Systeme für die Umwelt-, Lebensmittel- und Medizinanalytik dar.
Im Fokus der Stuttgarter Forscher, die von Kolleginnen und Kollegen der Institute für Materialwissenschaften, Physikalische Chemie, Polymerchemie, Technische Biochemie und des Max-Planck-Instituts für Intelligente Systeme sowie durch eine Vielzahl externer Kooperationen mit wissenschaftlichen Einrichtungen und Firmen unterstützt werden, steht dabei zunächst das molekulare Design der Hydrogele, d.h. neue synthetische Polymersysteme und niedermolekulare Quervernetzer sollen entwickelt, Monomer-Bausteine optimiert und zu neuen Hydrogelen umgesetzt werden, welche die resultierende Gel-Struktur und deren Quellbarkeit und Elastizität kontrollieren. Geeignete Materialtypen werden dann zur Entwicklung von Hydrogelformulierungen mit erweitertem Anwendungspotential genutzt. So werden beispielsweise superporöse Hydrogele hergestellt, die als Speicher oder Reaktionsräume dienen können. Durch neue Verarbeitungsverfahren für die porösen Hydrogelsysteme, insbesondere Sprühtrocknung und Inkjet-Druck, werden räumlich definierte makroskopische Systeme für verschiedene Applikationen entwickelt. Pflanzenvirusderivate (z.B. vom Tabakmosaikvirus abgeleitet) dienen hierbei als robuste und zugleich "intelligente" Gerüstkomponenten und können dem Hydrogel maßgeschneiderte sensorische Eigenschaften verleihen oder es in ein Transportsystem für Medikamente verwandeln. Mineralisationsvermittelnde Peptide, die der Natur aus den Haftproteinen von Muscheln und Seepocken "abgeschaut" wurden, sowie mineral-abscheidende Zellen mariner Organismen (Korallen, Seeigel) sollen dazu genutzt werden, die Porösität der Gele zu beeinflussen und lokal gehärtete Gelkapseln herzustellen. Neben der wissenschaftlichen Bearbeitung stellt das Projekthaus NanoBioMater darüber hinaus die notwendige Infrastruktur an Geräten und analytischen Instrumenten zur Verfügung, kümmert sich um Fragen der Biokompatibilität und stellt Kontakte zu Anwendern, externen Kooperationspartnern und Industrieunternehmen her. Für den wissenschaftlichen Nachwuchs, kooperierende Forscher und Firmen, internationale Experten und interessierte Gäste werden Tagungen und Workshops ausgerichtet.
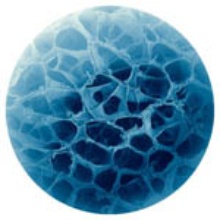
Abbildung: Hydrogel-basierte Materialien (Institut für Grenzflächenverfahrenstechnik und Plasmatechnologie, Hirth/Tovar)
| Datei-Anhänge |
|---|