Implantate, wie zum Beispiel Hüftprothesen, werden heute routinemäßig in der Klinik eingesetzt. Obwohl es sich bei den Operationen zum Gelenkersatz um Standardeingriffe handelt, treten nach diesen Eingriffen vielfach Komplikationen auf. Diese betreffen insbesondere die Langzeitstabilität der Prothesen, da die Implantatmaterialien keine vollständige Verankerung im Knochen erreichen. Zudem kommt es häufig zu einer verschlechterten Heilung der Wunden, wenn – wie im Beispiel von Endo-Exo-Prothesen – Teile der Implantate aus diesen Wunden herausragen.
Ziel
Das Ziel des Vorhabens ist die Entwicklung von Verfahren, die eine verbesserte Verträglichkeit und eine möglichst lebenslange Integration von Implantaten, hier beispielhaft für Titanimplantate, ermöglichen. Hierbei sollen zwei Strategien verfolgt werden.
Zum einen sollen Titansubstrate mit zellspezifischen Kohlenhydraten modifiziert werden, die so eine verbesserte Adhäsion und Proliferation der Zellen auf dem Titan ermöglichen. Geeignete Kohlenhydratstrukturen sollen zunächst durch Screening von Zelladhäsion und ‑wachstum auf Kohlenhydrat-Microarrays identifiziert und anschließend kovalent an silanisierte Titanoberflächen gebunden werden.
In der zweiten Strategie wird die kovalente Anbindung der Zellen an Titansubstrate angestrebt. Hierzu werden die Zellen durch metabolisches Oligosaccharid-Engineering (MOE) derartig verändert, dass sie Glykane mit modifizierten Kohlenhydraten auf ihren Oberflächen präsentieren. Die Bindung an die Titanoberfläche soll dann über eine chemoselektive Ligationsreaktion zwischen funktionellen Gruppen in den modifizierten Glykanen und komplementären funktionellen Gruppen auf dem Metall erfolgen. Sind die Zellen danach weiterhin viabel und proliferationsfähig, wäre eine neue Form der Oberflächenanbindung gefunden.
Vorgehen
Zur Evaluierung der Zelladhäsion vermittelt durch Zuckerstrukturen wurden auf den von der Universität Konstanz gelieferten Microarrays HaCaT-Keratinozyten ausgesät und sowohl die Zellzahl als auch die Inkubationszeit variiert. Bereits eine sehr kurze Inkubationszeit von 30 Minuten hat Unterschiede in der Zelladhäsion zur Folge. Dies lässt darauf schließen, dass die Monosaccharide vor allem bei der initialen Zelladhäsion eine Rolle spielen.
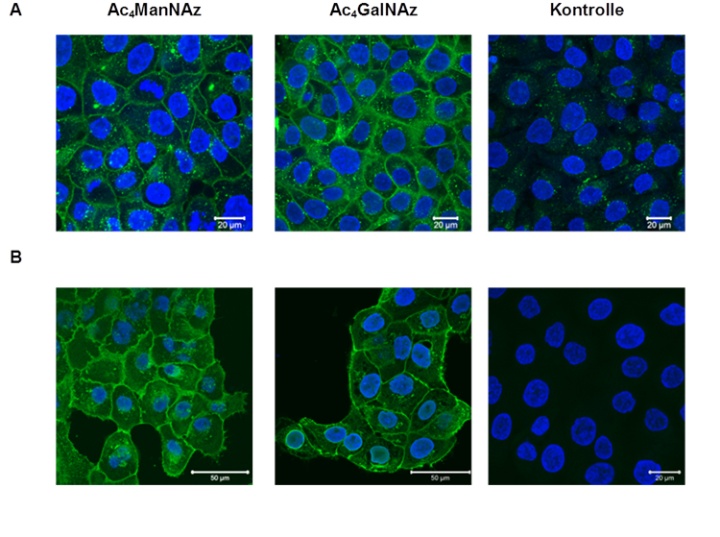
Die Methode des metabolischen Oligosaccharid-Engineerings wurde erfolgreich etabliert. An den Zellen der Keratinozyten-Zelllinie HaCaT konnte gezeigt werden, dass die azid-modifizierten Zucker von den Zellen metabolisiert und in die Zellmembran eingebaut werden. Die Azide konnten sowohl Kupfer-katalysiert als auch Kupfer-frei an einen Alkin-modifizierten Fluorophor gekoppelt und so mikroskopisch nachgewiesen werden.
Metabolisches Oligosaccharid-Engineering von Zellen der HaCaT-Keratinozyten-Zelllinie. Der Nachweis der Azide erfolgte mit Ac4ManNAz bzw. Ac4GalNAz durch (siehe Abbildung unten, A) Kupfer-freie oder (siehe Abbildung unten, B) Kupfer-katalysierte Klick-Reaktion an einen Alkin-funktionalisierten Fluorophor.
Es wurden silanisierte Substrate mit Alkin funktionalisiert. Auf diesen Oberflächen adhärieren die Zellen unabhängig von dieser Gruppe sehr gut. Der Nachweis der kovalenten Anbindung der Zellen sollte mittels eines Migrations-Versuchs erbracht werden.
Es wurden die Azid-modifizierten Zellen auf Alkin-funktionalisierten Oberflächen ausgesät und die Adhäsion bzw. die Zellmigration untersucht. Da sowohl die Azid-modifizierten HaCaTs als auch die Kontroll-Zellen auf der Alkin-Oberfläche migierten, konnte noch kein Nachweis zur Immobilisierung der Zellen erbracht werden.
Förderung und Projektpartner
Das Projekt ist eingebunden in das Programm „Glykomik“ gefördert durch die Baden Württemberg Stiftung.
Das Projekt wird zusammen mit der Universität Konstanz, Fachbereich Chemie, Prof. Dr. Valentin Wittmann durchgeführt.
Dies ist ein Gemeinschaftsprojekt der IGVP-Gruppen Chemisch-physikalische Grenzflächen und Biologisch-medizinische Grenzflächen.

Alexander Southan
Dr.Leiter Chemisch-physikalische Grenzflächen // Teamleiter Projekthaus NanoBioMater